結果 圖2顯示了碳酸鈉與HCl的滴定曲線。曲線中有兩個突然的pH變化。這些對應于以下連續反應: Na 2 CO 3 + HCl - > NaHCO 3 + NaCl(碳酸鹽轉化為碳酸氫鹽) NaHCO 3 + HCl - > CO 2 + H 2 O + NaCl 在該實驗中計算的HCl的摩爾濃度為0.95mol / l。
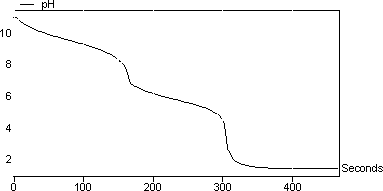 圖2:碳酸鈉對HCl的滴定曲線
圖2:碳酸鈉對HCl的滴定曲線
圖3顯示了反應的滴定曲線: NaOH + HCl→> NaCl + H 2 O. 該反應涉及強酸(HCl)和強堿(NaOH)。您可以注意到pH值從非常高的pH值變為非常低的pH值。在此類反應中,等當點的pH值為7.將光標移動到屏幕上,看到最陡的痕跡發生在pH 7 在該實驗中計算的NaOH的摩爾濃度為1.01mol / l。
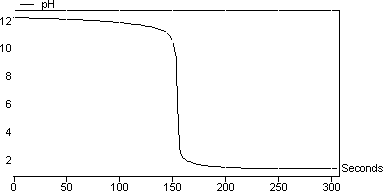 圖3:NaOH對HCl的滴定曲線
圖3:NaOH對HCl的滴定曲線
圖4顯示了用HCl滴定發酵粉末期間的pH變化。與碳酸鹽實驗相反,我們在這里只能看到一個突然的pH步驟,其對應于碳酸氫鹽轉化為二氧化碳。值得注意的是,圖4類似于圖2的第二部分。
 圖4:發酵粉對HCl的滴定曲線
圖4:發酵粉對HCl的滴定曲線
圖5顯示了醋對氫氧化鈉的滴定曲線。注意,由于添加NaOH,滴定期間溶液的pH增加。 涉及的反應是: CH 3 COOH + NaOH - > CH 3 COO-Na + + H 2 O. 在該實驗中計算的醋中乙酸的濃度為5.85%(w / w)
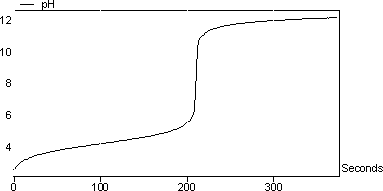 圖5:醋對NaOH的滴定曲線
圖5:醋對NaOH的滴定曲線
圖6與圖3相反,其中HCl用NaOH滴定。很明顯,在滴定強酸(例如HCl)的情況下,pH躍遷大于用堿滴定弱酸(例如乙酸)時的pH躍變。
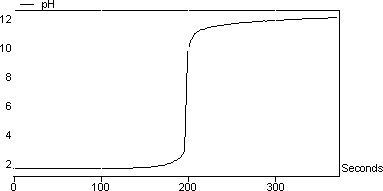 圖6:HCl對NaOH的滴定曲線
圖6:HCl對NaOH的滴定曲線
問題 1.解釋為什么圖3和6中等當點的pH值為7,而圖5中的pH值為8.86 2.計算圖5中的乙酸的pKa。 3.如果用HCl滴定0.1 mol / l碳酸鈉和0.1 mol / l碳酸氫鈉的混合物,則預測滴定曲線。 4.如果您沒有校準流速會發生什么?
進一步研究 1.重復第3部分,用HCl和NaOH的濃度減少10和100倍。研究濃度對pH變化的影響。 2.用H 3 PO 4代替HCl 重復第6部分。(你應該看到一條上升的曲線,其中兩個pH值跳躍對應于磷酸的前兩個氫原子) 3.繪制所有先前實驗的時間的一階導數(dpH / dt),并在每種情況下找到終點。一階導數曲線中的終點定義為最大值處的點。可以通過繪制諸如MicroCal Origin之類的程序來獲得一階導數曲線。(樣本如圖7所示)
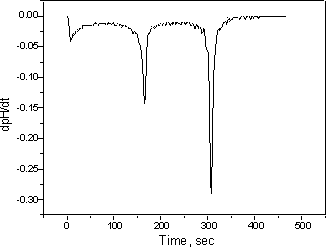 圖7:圖2的一階導數,用于更精確的終點位置。
圖7:圖2的一階導數,用于更精確的終點位置。
答案 1.圖3和圖6顯示了涉及強酸和強堿的滴定。當量點的溶液含有中性的鹽(NaCl),即pH7。而圖5顯示了弱酸(乙酸)對強堿(NaOH)的滴定。在該等當量點,溶液含有它們的鹽(乙酸鈉),它是堿性鹽,在這種情況下pH值> 7,8.86。 2.可以通過測定半中和時的pH來計算乙酸的pKa。此時pH = pKa(理論值= 4.74,實驗值4.6)。 3.第二步將是第一步的兩倍。 4.您仍然可以獲得滴定曲線,但您無法確定達到等當點所需的滴定劑體積,當然也無法計算未知濃度。
回到實驗